|
|
 发表于 2022-11-27 12:00:38
|
显示全部楼层
发表于 2022-11-27 12:00:38
|
显示全部楼层
撰文 | 十一月
当遇到高渗透性挑战时,脱水的细胞必须迅速恢复正常体积才能够存活。在高渗应激过程中,细胞通过组织离子转运体、离子通道以及离子泵系统来适应体积的收缩,这些转运体、离子通道等帮助水的回收【1】,该过程被称为体积调节增加(Regulatory volume increase,RVI),这一应急措施使得细胞有时间合成渗透液并启动对长期生存非常关键的转录程序【2】。其中WNK激酶(With-no-lysine kinase)在高渗应激期间对于协调体积恢复起着关键作用。WNK激酶调控SLC12阳离子氯离子转运蛋白的磷酸化,但是WNK激酶是如何被细胞收缩激活的还不甚清楚。
2022年10月31日,美国匹兹堡大学Arohan R. Subramanya研究组的发文题为WNK kinases sense molecular crowding and rescue cell volume via phase separation,发现当细胞处于高渗的环境中,WNK1会形成无膜凝聚体启动的磷酸化依赖的信号通路,促进SLC12共转运体驱动离子内流恢复细胞体积。

WNK1是一种广泛表达的丝氨酸苏氨酸激酶,高渗透胁迫会使得WNK1从均匀分布转变为点状分布,但是这些点状信号的作用尚不清楚。通过活体成像,作者们发现瞬时表达大鼠的WNK1在高渗条件下会与下游磷酸化激活效应因子共定位,这说明细胞中斑点的形成可能会参与细胞的高渗响应。
进一步地,作者们发现WNK1点状信号具有类似于液体的特征,点状信号呈现圆形、能够融合以及形成润湿的表面且通过相关光和透射电子显微镜发现WNK1点状信号是无膜结构,由此作者们认为WNK1在高渗情况下所形成的点状信号是由相分离介导的。
随后,作者们发现内源生理水平的WNK1在高渗胁迫诱导下也会形成凝聚体。进一步通过对应激小体以及P小体标记物染色,作者们发现WNK1在高渗胁迫下形成的凝聚体是独立于这两种小体而存在的。蛋白质的相分离是由内在无序序列介导的,通过对WNK1结构域分析,作者们发现WNK1激酶C末端的内在无序序列结构WNK1的相分离。
随后,作者们之前大鼠WNK1激酶相分离特征是否是在其他物种的WNK1中存在。作者们发现人WNK1、果蝇WNK1以及线虫WNK1等虽然序列相似性很低,但是同样具有相分离特征。因此,在早期脊椎动物进化过程中,WNK1激酶的C末端在进化过程中保留了无序特征,从而保留了相分离的特性,说明WNK1激酶形成凝聚体的能力是一种古老的基本性质。
进一步地,作者们发现WNK1激酶的C末端对于离子转运以及RVI非常关键,通过将WNK1激酶的C末端置换成为其他具有相分离活性的片段比如FUS、TDP43等能够挽救RVI。因此,作者们确认WNK1是一个分子拥挤感应器。
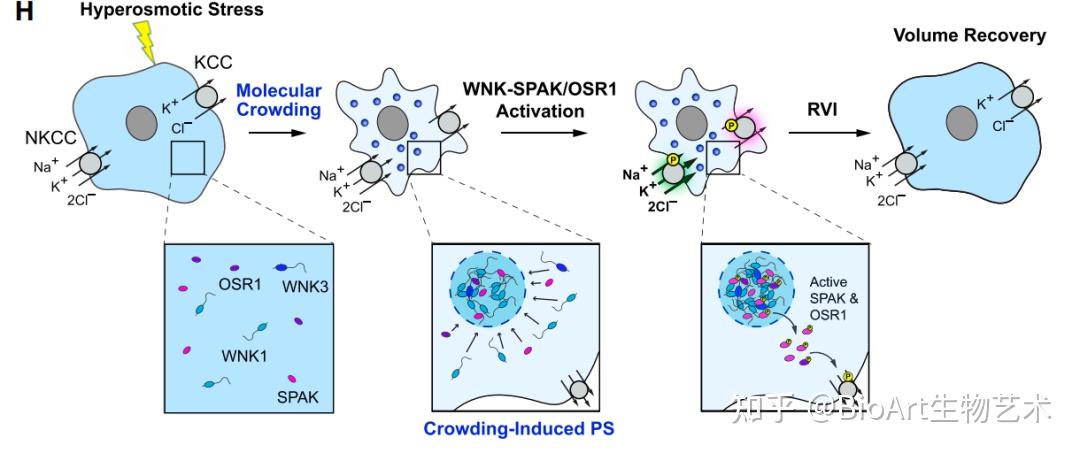
图2 工作模型
总的来说,作者们的工作发现在细胞暴露于高渗环境中,WNK1集中成无膜凝聚体,启动磷酸化依赖的信号,通过SLC12共转运体驱动净离子流入,恢复细胞体积(图2)。WNK1凝聚体的形成是由其固有内在无序序列C末端驱动,其进化保守特征对于有效的相分离和体积回收是必要的,从而揭开了WNK1作为分子拥挤感应器的作用机制。
原文链接:
https://doi.org/10.1016/j.cell.2022.09.042
参考文献
1. Delpire, E., and Gagnon, K.B. (2018). Water homeostasis and cell volume maintenance and regulation. Curr. Top. Membr. 81, 3–52.
2. Burg, M.B. (1995). Molecular basis of osmotic regulation. Am. J. Physiol. 268, F983–F996
转载须知【原创文章】BioArt原创文章,欢迎个人转发分享,未经允许禁止转载,所刊登的所有作品的著作权均为BioArt所拥有。BioArt保留所有法定权利,违者必究。 |
|